Nota: Para ver las imágenes completas hacer click en ellas o click derecho y seleccionar abrir imagen.
Reacciones de óxido–reducción o REDOX
Son aquellas donde está involucrado un cambio en el número de electrones asociado a un átomo determinado, cuando este átomo o el compuesto del cual forma parte se transforma desde un estado inicial a otro final.
La gran mayoría de las reacciones redox ocurren con liberación de energía. Por ejemplo: la combustión de compuestos orgánicos que proporciona energía calórica, las reacciones que se realizan en una pila o batería, donde la energía química es transformada en energía eléctrica, y las reacciones más importantes, desde el punto de vista de nuestro curso, que ocurren a nivel del metabolismo de un ser viviente. Como los alimentos son substancias reducidas, el organismo las oxidada controladamente, liberando energía en forma gradual y de acuerdo a sus requerimientos. Esta energía es transformada en energía química en forma de ATP, la cual es utilizada para todos los procesos endergónicos que ocurren en los organismos.
Un átomo neutro cualquiera tiene un número definido de electrones, el cual corresponde al número de protones que posee su núcleo; es decir, tiene tantos electrones como el valor de su número atómico.
Por ejemplo:
H Z = 1; es decir 1 protón y 1 electrón
Na Z = 11; es decir 11 protones y 11 electrones
Generalmente, cuando un elemento determinado se combina a través de una reacción química, el número de electrones que está asociado a él, puede ser mayor o menor que su número atómico característico. De aquí nace el concepto de estado de oxidación o número de oxidación. Lo que simplemente significa, el número de electrones en exceso o de déficit que se le asigna a un elemento con respecto a su número atómico.

El Potencial de oxidación reducción estandar ( E0 ).
Hemos idealizado los acontecimientos con el objeto obtener una aproximación " intuitiva " a la noción de potencial de oxidación - reducción.
Vamos a ver que es y como se realiza la cuantificación del potencial de oxidación - reducción estandar de una sustancia a la que llamamos "problema", que presenta dos formas moleculares ( oxidada y reducida ) :
Se dispone un sistema con dos cubetas. En una de ellas ( izquierda en el dibujo ) vamos a poner un par de oxidación-reducción que es el par hidrógeno - protón. A este par le llamamos par de referencia; es decir, que la afinidad por los electrones de otros pares se va referir al de hidrógeno - protón.
El hidrógeno es un gas y por lo tanto hay que hacerlo burbujear en la cubeta desde una botella de hidrógeno, hasta que se consigue una presión parcial de hidrógeno de 1 atmósfera ( concentración estandar de los gases ).
Ajustando el tampón de esta cubeta a pH = 0 estamos fijando la concentración de protones exactamente a 1 M ( concentración estandar del protón para los químicos ). Con ello ya tenemos lista la cubeta de referencia, formada por el par hidrógeno - protón en condiciones estandar desde un punto de vista químico ( concentraciones de 1 atmósfera y 1 M respectivamente ).
Ahora hay que preparar la otra cubeta ( derecha en el dibujo ), donde vamos a disponer el par de oxidación - reducción cuya afinidad por los electrones queremos cuantificar; es decir, el par de oxidación - reducción formado por la sustancia A ( miembro oxidante del par ) y la sustancia A- ( miembro reducido del par ). Para ello ponemos ambos miembros del par a una concentración de 1 M ( concentración estandar para solutos no gaseosos solubles en agua ).
Además hay que ajustar el tampón de la cubeta "problema" a un pH = 0; es decir, al mismo valor que la cubeta de referencia. Esto es una condición necesaria para hablar de potencial de oxidación - reducción estandar E0.
Una vez preparadas las cubetas disponemos un puente de agar / KCl entre las mismas ( amarillo en el dibujo ) con el objeto de mantener el equilibrio eléctrico.
A ello hay que añadir un voltímetro conectado a ambas cubetas mediante sendos electrodos. Esto va a permitir el flujo de electrones en una u otra dirección, siendo medido dicho flujo mediante el voltímetro, que nos dará la medición del potencial de oxidación - reducción estandar E0, que se expresa en voltios o en milivoltios.
Si se diese el caso representado en el siguiente dibujo, donde los electrones van de la cubeta de referencia ( izquierda ) a la cubeta problema ( derecha ), entonces diremos que el par problema tiene un potencial de oxidación - reducción mayor que el par de referencia. Como al par de referencia convenimos en asignarle el valor de 0 V, cualquier otro par que acepte electrones del par de referencia decimos que tiene potencial redox o de oxidación - reducción standar E0 mayor de 0 ( E0 es positivo ).
Además hay que ajustar el tampón de la cubeta "problema" a un pH = 0; es decir, al mismo valor que la cubeta de referencia. Esto es una condición necesaria para hablar de potencial de oxidación - reducción estandar E0.
Una vez preparadas las cubetas disponemos un puente de agar / KCl entre las mismas ( amarillo en el dibujo ) con el objeto de mantener el equilibrio eléctrico.
A ello hay que añadir un voltímetro conectado a ambas cubetas mediante sendos electrodos. Esto va a permitir el flujo de electrones en una u otra dirección, siendo medido dicho flujo mediante el voltímetro, que nos dará la medición del potencial de oxidación - reducción estandar E0, que se expresa en voltios o en milivoltios.
Si se diese el caso representado en el siguiente dibujo, donde los electrones van de la cubeta de referencia ( izquierda ) a la cubeta problema ( derecha ), entonces diremos que el par problema tiene un potencial de oxidación - reducción mayor que el par de referencia. Como al par de referencia convenimos en asignarle el valor de 0 V, cualquier otro par que acepte electrones del par de referencia decimos que tiene potencial redox o de oxidación - reducción standar E0 mayor de 0 ( E0 es positivo ).
En este ejemplo vemos como el compuesto A tiene una gran afinidad por los electrones para reducirse o transformarse en la forma reducida ( A- ), mientras que el protón ( H+ ) tiene menos afinidad para convertirse en Hidrógeno ( H2 ). Ello hace que el compuesto A " tire " de los electrones, y trae como consecuencia un flujo de electrones desde la otra cubeta, donde se encuentra el Hidrógeno ( H2 ) y su forma oxidada : el protón ( H+ ).
En resumen, podemos establecer como serán las transformaciones globales en cada cubeta :
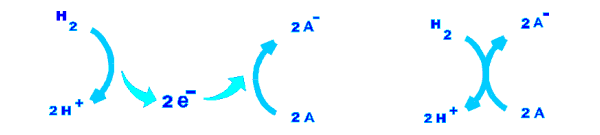
En la izquierda se resume el proceso : el Hidrógeno ( H2 ) se oxida a dos protones ( H+ ) liberando dos electrones; los electrones pasan de una cubeta a otra a través del hilo conductor y en la otra cubeta son aceptados por la forma oxidada de A ( A ) que se reduce a la forma reducida de ( A- ). En la derecha el mismo proceso se representa más esquematizado.
En resumen, podemos establecer como serán las transformaciones globales en cada cubeta :
En la izquierda se resume el proceso : el Hidrógeno ( H2 ) se oxida a dos protones ( H+ ) liberando dos electrones; los electrones pasan de una cubeta a otra a través del hilo conductor y en la otra cubeta son aceptados por la forma oxidada de A ( A ) que se reduce a la forma reducida de ( A- ). En la derecha el mismo proceso se representa más esquematizado.
Los Radicales libres son vistos como agentes tóxicos y productores de enfermedades desde el año 1954, descubierto por la investigadora argentina Dra. Rebeca Gerschman. La cual los describió como “moléculas que en su estructura atómica presentan un electrón impar en la orbita externa y una configuración espacial que genera una alta inestabilidad”
A partir de la molécula de oxígeno gaseoso (02) se forman los siguientes reactivos (radicales libres): 02 (anión superóxido), H202 (peróxido de hidrógeno) y H0 (anión hidroxilo)
La formación de radicales libres es parte de la función normal de las células, siendo un proceso continuo. Reaccionan con moléculas de grasa, proteínas o ADN; dañándolas, transformándolas o incurriendo a muerte celular. Asi como consecuencia malformaciones, tumores o enfermedades como el cáncer, envejecimiento prematuro, enfermedades cardiovasculares, entre otras. Al reaccionar con otro radical libre empieza una reacción en cadena, incluso en ocasiones hay moléculas que al reaccionar con radicales libres quedan como radical también.
Existen muchos productores de radicales libres, desde procesos normales (metabolismo de los alimentos, la respiración y el ejercicio extenuante), contaminantes del medio ambiente (polución industrial, tabaco, radiación, medicamentos, aditivos químicos en los alimentos procesados y pesticidas, rayos ultravioletas, humo de fabricas, de cigarrillos y tabaco, de autos), estrés o mal manejo de emociones, ruido excesivo, olores fuertes.
Hay que recordar que la oxidación (proceso de acción de los radicales libres) es un proceso normal de equilibrio, pero si no se controla nos puede perjudicar en gran medida. Por equilibrio también podemos encontrar la ayuda de enzimas y nutrientes antioxidantes que ayudan a neutralizar a los radicales libres previniendo los daños ocasionados por estos.

No hay comentarios:
Publicar un comentario