Hay 4 tipos de propiedades coligativas:
- Disminucion de presion de vapor
- Elevacion del punto de ebullicion
- Disminucion del punto de fusion
- Presion osmotica
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores: 
- La disminución del número de moléculas del disolvente en la superficie libre y
- La aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor.
 ción matemática de este hecho viene expresada por la observación de Raoult de que el descenso relativo de la presión de vapor del disolvente en una disolución es proporcional a la fraccion molar del soluto (2)
ción matemática de este hecho viene expresada por la observación de Raoult de que el descenso relativo de la presión de vapor del disolvente en una disolución es proporcional a la fraccion molar del soluto (2) 
![]()
Esta fórmula nos permite enunciar la ley de Raoult: la presión de vapor de la disolución es igual a la presión de vapor del disolvente por la fracción molar del disolvente en la disolución. Esta fórmula tiene validez para todas las disoluciones verdaderas. (2)
Elevacion del punto de ebullicion
Estamos asumiendo que el soluto es un compuesto no volátil, lo cua l, implica que no hace ninguna contribución significativa a la pr
l, implica que no hace ninguna contribución significativa a la pr
esión de vapor de la solución. Si el soluto fuese un compuesto volátil, con un punto de ebullición más bajo, llevaría el punto de ebullición del solvente a valores más bajos. Si nuestro solvente originalmente tiene un punto de ebullición normal (p1 = 1 atmósfera) y se agrega un soluto no volátil, bajará la presión de vapor y la mezcla no hervirá. Para llevar la solución a ebullición, debe aumentarse la temperatura. Por lo anterior, el punto de ebullición de la solución es más alto que el del
solvente puro. (1)
Disminucion del punto de fusion
El punto de congelación de una solución es la temperatura a la cual comienzan a formarse los cristales de solvente puro en equilibrio con la solución. (3)
Presion osmotica
Ciertos materiales, incluyendo muchas membranas de los sistemas biológicos y sustancias sintéticas como el celofán son semipermeables. Cuando se ponen en contacto con una solución, ellas permiten el paso de algunas moléculas pero no de otras. Generalmente permiten el paso de las moléculas pequeñas de solvente como el agua pero bloquean el paso de solutos más grandes o iones. El carácter semipermeable, se debe a la red de poros diminutos de la membrana.
Consideremos una situación en la cual solamente las moléculas de solvente pueden pasar a través de la membrana. Si esa membrana se coloca entre
dos soluciones de diferente concentración, las moléculas de solvente se moverán en ambas direcciones a través de la membrana. Sin embargo la concentración del solvente es mayor en la solución que contiene menos soluto que en la más concentrada. Por consiguiente la tasa de paso del solvente desde la solución menos concentrada hacia la más concentrada es mayor que la velocidad en la dirección o
puesta. Así hay un movimiento neto de las moléculas de solvente desde la solución menos concentrada hacia la más concentrada, este proceso se llama osmosis, Siempre, el movimiento neto del solvente es siempre hacia la solución con la concentración de solutos más alta. (3)
La presión necesaria para evitar la ósmosis se conoce como presión osmótica de la sol ución.
ución.
p= m R T
donde p representa la presión osmótica, m es la molalidad de la disolución, R es la constante universal de los gases y T es la temperatura absoluta.
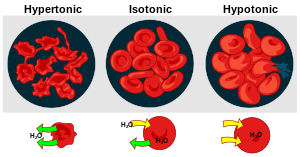
Si comparamos la presión osmótica de dos disoluciones podemos definir tres tipos de disoluciones:
- disoluciones isotónicas son aquéllas que manifiestan la misma presión osmótica que la disolución de referencia
- disoluciones hipotónicas son aquéllas que manifiestan menor presión osmótica que la disolución de referencia
- disoluciones hipertónicas son aquéllas que manifiestan mayor presión osmótica que la disolución de ref erencia (2)

Gracias por la información, me sirvió un monton. :)
ResponderEliminar